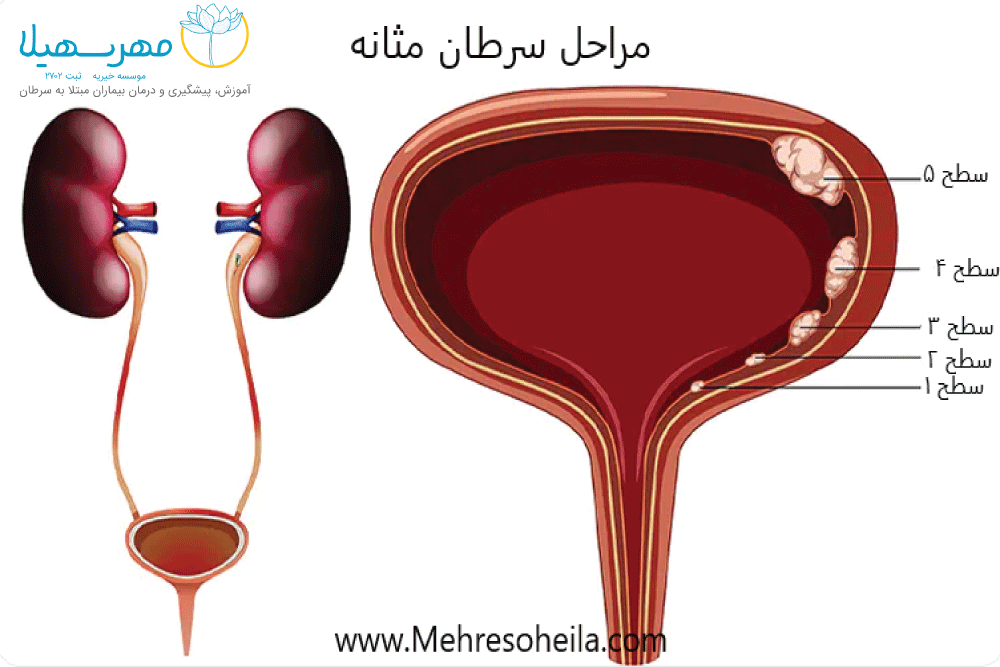
نوروفیبروماتوز چیست؟
نوروفیبروماتوز به انگلیسی Neurofibromatosis یک بیماری ژنتیکی است که اعصاب و پوست را گرفتار میکند. در این بیماری تومورهای خوشخیم غیر سرطانی در مسیر اعصاب رشد میکنند و این رشد موجب بروز مشکلاتی در پوست و استخوانها میشود.
انواع نوروفیبروماتوز
نوروفیبروماتوز انواع 1 و 2 (NF1, NF2) و شوانوماتوز بیماری هایی هستند که طیف نوروفیبروماتوز را تشکیل می دهند. بخشی از گروه سندرم های نادر سرکوبگر تومور را تشکیل می دهند. آنها نسبت به هر نوع بیماری نئوپلاستیک دیگری، بار تومور بیشتری را برای سیستم عصبی ایجاد می کنند. رویکردهای جدید برای درمان علامتی در حال ظهور است.
نوروفیبرومین
هنگامی که نوروفیبرومین همانطور که باید کار می کند، تشکیل تومورها را سرکوب می کند، از جمله در نورون ها و سلول های تخصصی که آنها را می پوشانند.
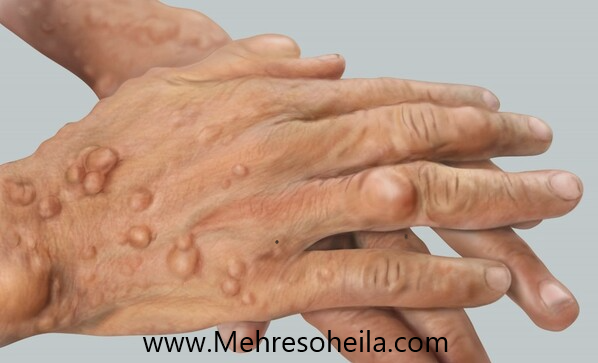
اشتباه در این پروتئین می تواند باعث تغییر رنگ پوست و تومورهای خوش خیم در اطراف رشته های عصبی شود که به صورت برجستگی روی پوست ظاهر می شوند.
در موارد شدیدتر، بیماران ممکن است تومورهای عصبی بزرگتر و تهاجمی تر و همچنین ناهنجاری های استخوانی، مشکلات رشدی و گاهی اوقات سرطان داشته باشند. این عوارض اغلب با رشد کودک ظاهر می شوند.
نوروفیبروماتوز نوع 1 (NF1)
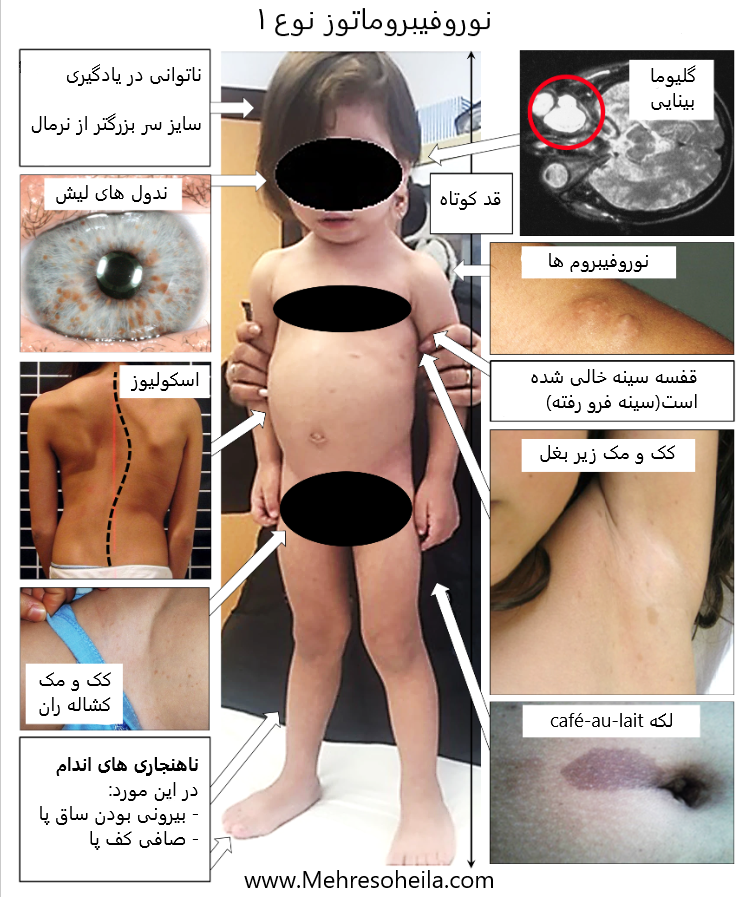
NF1 (بیماری فون رکلینهاوزن) یک سندرم ژنتیکی تومور است که با ناهنجاریها و رشد تومور در سیستم عصبی و سایر سیستمهای اندام مرتبط است . فراوانی آن تقریباً 1 در هر 3000 نوزاد بدون توجه به جنسیت و قومیت است. تشخیص بر اساس دلایل بالینی با کمک معیارهای تعریف شده توسط مؤسسه ملی بهداشت (NIH) انجام می شود . امید به زندگی افراد مبتلا تقریباً 15 سال کمتر از حد طبیعی است که عمدتاً به دلیل بدخیمیها و همچنین به دلیل حمله قلبی و سکته مغزی است.
تظاهرات بالینی
نوروفیبروم
اکثر بیماران مبتلا به NF1 دارای نوروفیبروم پوستی (CNF) هستند . اینها معمولاً ابتدا در نوجوانی ظاهر می شوند و در بزرگسالی بیشتر می شوند .
علاوه بر این، 30-50٪ از بیماران NF1 دارای نوروفیبروم زیر جلدی و پلکسی فرم (PNF) هستند . PNF در حال حاضر در جنین وجود دارد. آنها در ابتدا خوش خیم هستند و به شکل مشبک رشد می کنند و بافت طبیعی را جابجا می کنند.
در حدود 8 تا 13 درصد از بیماران NF1، PNF به تومورهای بدخیم غلاف عصبی محیطی (MPNST) تبدیل می شود.
تومورهای دیگر
خطر ابتلا به بدخیمی های خونساز، به ویژه لوسمی میلوئید، در کودکان مبتلا به NF1 تقریباً هفت برابر افزایش می یابد. تومورهای مرتبط با NF و تومورهای پراکنده دارای پیش آگهی یکسان هستند و به طور یکسان درمان می شوند.
به ویژه در زنان زیر 50 سال، خطر ابتلا به سرطان سینه به طور قابل توجهی افزایش می یابد (تقریباً پنج برابر) .
فئوکروموسیتوم خوش خیم غدد فوق کلیوی در بیماران NF1 بسیار شایع تر از جمعیت عمومی است، اگرچه هنوز نادر است (بروز 5٪ در مقابل 1٪) . کودکان مبتلا به NF1 نیز در معرض خطر ابتلا به رابدومیوسارکوم، عمدتاً در مثانه و غده پروستات هستند .
تومورهای استرومای گوارشی (GIST) با فرکانس بالا در برخی از جمعیت های مورد مطالعه یافت شده است. تومورهای غدد درون ریز نیز گاهی اوقات توصیف شده اند.
سیستم عصبی مرکزی
بیماران مبتلا به NF1 در معرض خطر ابتلا به گلیوماهای با درجه پایین و درجه بالا هستند. شایع ترین نوع، آستروسیتومای پیلوسیتیک عصب بینایی است که در 15 درصد از بیماران NF1 دیده می شود که تقریباً نیمی از آنها بدون علامت هستند .
ساقه مغز دومین محل شایع است. مهمترین عنصر مراقبت از بیماران مبتلا به گلیوما درجه پایین، نظارت بر پیشرفت بیماری است.
گلیوماهای عصب بینایی می توانند به طور قابل توجهی در اوایل کودکی رشد کنند، اما اغلب از 7 سالگی به بعد ثابت می مانند .
کودکان مبتلا به طور متوسط دارای هوش خفیف پایین تری هستند و 60 تا 81 درصد دارای نقص عملکرد جزئی خاص (نارساخوانی، دیسکالکلیا و غیره) یا اختلال کمبود توجه (AD[H]D) هستند.
تقریباً 11٪ دارای یک اختلال از طیف اوتیسم هستند که شیوع قابل توجهی بالاتر از جمعیت عمومی (1٪) است. با این حال، این ارقام فراوانی را نمی توان نماینده کل کودکان مبتلا به NF1 در نظر گرفت، زیرا اثر پیش انتخابی دارد .
ناهنجاری های رنگدانه
ناهنجاری های رنگدانه به خودی خود بیماری نیستند، اما از نظر تشخیصی مفید هستند. لکههای Café-au-Lait اغلب تظاهرات بالینی اولیه NF1 هستند. نود و نه درصد از بیماران NF1 دارای شش یا بیشتر از این لکه ها با قطر حداقل 5 میلی متر در پایان سال اول زندگی خود هستند . کک و مک زیر بغل و اینگوینال علامت دیگری است که تنها در 40 درصد از کودکان نوپا مبتلا به NF1 مشاهده می شود، اما در 90 درصد از بیماران در سن 7 سالگی .
تظاهرات اسکلتی عضلانی
ناهنجاری های اسکلتی معمولی عبارتند از اسکولیوز، دیسپلازی بال اسفنوئید و دیسپلازی مادرزادی تیبیا و استئوپنی. خطر شکستگی در کودکان مبتلا به NF1 3.4 برابر و بزرگسالان بالای 41 سال 5.2 برابر افزایش می یابد (33.3٪ در مقابل 6.3٪ میزان شکستگی، P <0.001). این، در میان چیزهای دیگر، با سطح ویتامین D3 به طور قابل توجهی پایین تر مرتبط است.
درمان
هیچ درمان علّی جهت دار NF1 هنوز در دسترس نیست. مهمترین عناصر مدیریت، تشخیص زودهنگام و درمان مبتنی بر علائم است.
مشاوره ژنتیک از اهمیت ویژه ای برخوردار است. نقایص شناختی و تأخیرهای رشدی باید زود تشخیص داده شوند و با آموزش مناسب با نیازهای ویژه برطرف شوند.
AD(H)D را می توان به طور خاص با محرک ها (متیل فنیدات) در دوران کودکی و بزرگسالی درمان کرد. نوروفیبروم های جلدی را می توان به دلایل زیبایی یا پزشکی (درد، التهاب) با جراحی برداشت.
درمان جراحی PNF یک چالش بین رشته ای است. MRI و PET برای طبقه بندی خطر ضروری هستند.
برای تومورهای بدخیم غلاف عصبی محیطی (MPNST)، برداشتن کامل جراحی تنها رویکرد درمانی است که شانس درمان را ارائه می دهد.
معاینات چشم پزشکی سالانه نسبت به مطالعات تصویربرداری برای تشخیص گلیوما علامت دار عصب بینایی حساس تر است.
برای بیماران مبتلا به نقص بینایی، شیمی درمانی نشان داده می شود. رادیوتراپی به دلیل خطر بالای بدخیمی های دوم و گلیوماهای درجه بالاتر بحث برانگیز است.
کمبود ویتامین D3 در صورت وجود باید جایگزین شود.
امیدواری پژوهشی
بنیاد تومور کودکان (CTF) خوشحال است که شروع یک برنامه تحقیقاتی در رویکردهای درمانی مبتنی بر ژن برای درمان نوروفیبروماتوز نوع 1 (NF1) را اعلام کند. این ابتکار از طریق این درخواست برای برنامه های کاربردی (RFA) با هدف اول تامین مالی دو مطالعه اثبات اصل در ویرایش ژن NF1 آغاز می شود.
هدف از این RFA حمایت از اثبات اصل مطالعات آزمایشگاهی برای بررسی امکانسنجی تکنیکهای ویرایش ژنوم، از جمله اما نه محدود به تکنیکهای مبتنی بر CRISPR-Cas9، برای اصلاح جهشهای بیماریزا در ژن NF1 است. هدف نهایی این ابتکار، کشف توسعه ویرایش ژنوم به عنوان یک ابزار درمانی بالقوه برای NF1 است.
نتایج تجربی باید شامل موارد زیر باشد: (1) شواهدی که نشان میدهد آیا معرفهای ویرایش میتوانند جهش(ها) را تصحیح کنند (و خصوصیات اثرات خارج از هدف)، (2) درجه موفقیت در تحویل معرفها به سلولهای شوان، و (3) عملکرد سنجش اثربخشی را نشان می دهد.
نوروفیبروماتوز نوع 2 (NF2)
NF2 یک سندرم تمایل تومور با توارث اتوزومال غالب است که تقریباً در 1 مورد در هر 33000 تولد یافت می شود (جدول 1) (13, e27). نیمی از موارد از طریق جهشهای de novo ایجاد میشوند.
طول عمر این بیماری در سال های اخیر به دلیل تشخیص زودهنگام، درمان در مراکز چند رشته ای و درمان های نوآورانه با هدف حفظ عملکرد عصبی به طور پیوسته افزایش یافته است. میانگین طول عمر افراد مبتلا به NF2 در کشورهای صنعتی اکنون بیش از 60 سال است.
ژنتیک و پاتوفیزیولوژی مولکولی
ژن NF2 در سال 1993 شناسایی شد . این پروتئین سرکوبگر تومور مرلین را کد می کند. فرآیندهای تعمیر مداوم توسط سلول های شوان در یک ریزمحیط آکسونی تغییر یافته احتمالاً به تشکیل شوانوما کمک می کند.
از دست دادن مرلین منجر به فعال شدن مسیرهای سیگنال پرولیفراتیو از طریق مدولاسیون Ras می شود که بر اهدافی که در NF1 نیز شناسایی شده اند تأثیر می گذارد.
شوانوم ها و مننژیوم های پراکنده نیز از طریق تغییرات در این مسیرهای سیگنال ایجاد می شوند.
جهش های NF2 را می توان در خون تقریباً 91 درصد از بیماران با سابقه خانوادگی مثبت نشان داد. در بیماران مبتلا به جهش های نو، تجزیه و تحلیل جهش نتایج واضح کمتری (59٪) به همراه دارد.
موزاییک های ژنتیکی در 30 تا 60 درصد از تمام موارد جدید یافت می شوند.
این جهش تنها در بافت تومور به وضوح قابل اثبات است. موزاییک های ژنتیکی NF2 همچنین می توانند به فرزندان بیماران مبتلا منتقل شوند، با خطر بالای 8 تا 12٪ . چارچوب نظارتی برای تشخیص قبل از تولد و PID در NF2 مانند NF1 است.
تظاهرات بالینی
شوانوم عصب دهلیزی
شوانومای دو طرفه عصب دهلیزی (VS) در 90 تا 95 درصد بیماران مبتلا به NF2 ایجاد می شود.
گزینه های مدیریت
هدف اصلی درمان شوانوم دهلیزی دو طرفه جلوگیری از کاهش عملکرد قریب الوقوع، به ویژه کاهش شنوایی است . مداخلات جراحی چالش برانگیزتر از مدیریت VS پراکنده است.
اگر پس از جراحی شنوایی باقیمانده کافی وجود داشته باشد، توانبخشی شنوایی را می توان ابتدا با سمعک معمولی و سپس با کاشت حلزون شنوایی یا کاشت ساقه مغز شنوایی (ABI) انجام داد.
توقف رشد شوانوم عصب دهلیزی با استفاده از رادیوسرجری استریوتاکتیک در بیماران NF2 کمتر از تومورهای پراکنده حاصل می شود و دوزهای پرتوهای بالاتر می تواند کاهش شنوایی را تسریع کند .
درمان بدون برچسب بواسیزوماب با مهارکننده فاکتور رشد اندوتلیال عروقی (VEGF) اکنون به یک گزینه درمانی مهم تبدیل شده است. حداقل در میان مدت (طبق مطالعات گذشته نگر با فواصل پیگیری 1 تا 3 ساله)، با بهبود شنوایی در 57٪ و کوچک شدن تومور در 55٪ از بیماران همراه است، اگرچه خطر عوارض جانبی از جمله فشار خون بالا و پروتئینوری وجود دارد.
شوانومای دیگر
شوانومای اعصاب جمجمه ای در 24 تا 51 درصد از سایر بیماران NF2 یافت می شود .
تومورهایی که جمجمه تحتانی را تحت تأثیر قرار می دهند، به احتمال زیاد باعث ایجاد بیماری شدید با اختلال قابل توجه در کیفیت زندگی بیمار می شوند، زیرا با فلج تارهای صوتی (35٪) و دیسفاژی (50٪) همراه هستند.
شوانوم اعصاب محیطی (شایع ترین شوانوم های پارا نخاعی و زیر جلدی) در 70 درصد بیماران NF2 می شود .
برجسته شوانوماتوز، معمولاً به جای درد، با اختلالات حسی یا حرکتی علامت دار می شوند.
بررسی PNF در NF1، شوانوما در NF2 به ندرت دچار دگرگونی بدخیم می شوند.
مننژیوم
تقریباً 50٪ از بیماران مبتلا به NF2 مننژیوم دارند.
این تومورها با عوارض بالایی همراه هستند. یک پنجم همه کودکان مبتلا به مننژیوم NF2 دارند.
میزان بقای 5 ساله بدون پیشرفت پس از جراحی رادیوتاکتیک استریوتاکتیک برای مننژیوم تقریباً 86٪ است.
یک استراتژی ترکیبی میکروجراحی و رادیوسرجری عمدتاً در درمان مننژیومهای پاراساژیتال و تومورهای پتروکلیوال که به سینوس غار گسترش مییابند مفید است.
بیمارانی که بار سنگین مننژیوم دارند ممکن است دچار هیدروسفالی بد جذب شوند.
تومورهای ستون فقرات
شوانوم ها و مننژیوم های نخاعی در صورت فشرده شدن نخاع یا علامت دار شدن باید برداشته شوند.
اپندیموما
تقریباً تمام تومورهای داخل مدولری در بیماران مبتلا به NF2 اپندیموم هستند. این موارد در 33 تا 53 درصد از تمام بیماران مبتلا به NF2 ایجاد می شوند و 85 درصد در ستون فقرات گردنی قرار دارند .
در صورت پیشرفت، باید با میکروسرجری برداشته شوند. درمان با بواسیزوماب یک جایگزین است.
رفتار رشد تومورهای مرتبط با NF2 شوانوم و مننژیوم عصب دهلیزی داخل جمجمه دارای نرخ رشد سالانه مشابهی هستند که از 0.30 تا 2.57 سانتی متر مکعب در سال متغیر است .
شوانومای غیر دهلیزی بسیار کندتر رشد می کنند .
نوروپاتی محیطی
تقریباً 47 درصد از بیماران مبتلا به NF2 از نوروپاتی رنج می برند . مشخص نیست که آیا این میکروضایعات یک مرحله پیش ساز تومور را نشان می دهند.
عوارض چشمی
آب مروارید ساب کپسولی تقریباً در 80 درصد بیماران مبتلا به NF2 ایجاد می شود . سایر عوارض چشمی شامل غشاهای اپی رتینال، هامارتوم شبکیه، گلیوم و مننژیوم عصب بینایی و شوانوم داخل چشمی است. فلج عصب صورت قرنیه را در معرض خطر زخم قرار می دهد.
شوانوماتوز (SWN)
تنها از حدود سال 2005، شوانوماتوز به عنوان یک موجودیت جداگانه در نظر گرفته شده است. این تظاهرات بالینی مشابه NF2 دارد، بدون اینکه معیارهای تشخیصی را برآورده کند. گفته می شود که تقریباً در 1 مورد از هر 69000 تولد وجود دارد، اما شیوع آن ممکن است بسیار بیشتر باشد، زیرا بسیاری از موارد دارای علامت اولیگوستیک هستند. درد مزمن عموماً بارزترین علامت است.
ژنتیک و پاتوفیزیولوژی مولکولی
در شوانوماتوز، جهش های مختلف NF2 را می توان در بافت تومور یافت که در DNA سلول های خونی دیده نمی شود.
بخش کوچکی از بیماران دارای جهش در ژن SMARCB1 هستند. جهش در ژن LZTR1 شایع تر است.
به نظر می رسد که جهش های سوماتیک NF2 به طور ثانویه ایجاد می شوند. شوانوماتوز در کمتر از 20 درصد موارد چند نفر از یک خانواده را تحت تاثیر قرار می دهد.
الگوی وراثت نامشخص است.